Какие достижения в лечении сахарного диабета
 К настоящему времени, более чем полвека, мы сталкиваемся с увеличивающейся атакой диабета. Несмотря на миллиарды долларов, потраченных на исследование и лечение сахарного диабета, в настоящее время мы только можем управлять болезнью и делать условное лечение, но все же некоторые последние достижения в исследовании диабета дают нам новую надежду на окончательное лечение болезни в ближайшем будущем. От искусственной поджелудочной железы вырабатывающей необходимый уровень инсулина, до обнародования близкого родства между ожирением и заболеванием диабетом 2 типа, потенциал этих исследований огромен и по-настоящему новаторский. Во многих странах мира используется мониторинг уровня глюкозы и инсулиновые помпы в рамках оперативной системы управления диабетом.
К настоящему времени, более чем полвека, мы сталкиваемся с увеличивающейся атакой диабета. Несмотря на миллиарды долларов, потраченных на исследование и лечение сахарного диабета, в настоящее время мы только можем управлять болезнью и делать условное лечение, но все же некоторые последние достижения в исследовании диабета дают нам новую надежду на окончательное лечение болезни в ближайшем будущем. От искусственной поджелудочной железы вырабатывающей необходимый уровень инсулина, до обнародования близкого родства между ожирением и заболеванием диабетом 2 типа, потенциал этих исследований огромен и по-настоящему новаторский. Во многих странах мира используется мониторинг уровня глюкозы и инсулиновые помпы в рамках оперативной системы управления диабетом.
Число больных сахарным диабетом растет во всем мире стремительно и в соответствии этому, медицинские исследования сосредотачиваются на разнообразных областях исследования для того, чтобы достигнуть окончательного излечения диабета. В течение многих лет инъекции инсулина и некоторые вспомогательные препараты являются главным в лечении сахарного диабета и, несмотря на это, диабет неуклонно распространяется в различных возрастных группах и регулярно уносит жизни. По данным Всемирной организации здравоохранения в настоящее время 176 миллионов человек по всему миру страдают от болезни, и 95% пациентов среди них страдают от диабета 2 типа. Давайте теперь взглянем на некоторые из наиболее перспективных и новейших достижений в исследовании диабета.
- Инсулиновая помпа и мониторинг глюкозы в реальном времени
Эта сложная технология мониторинга глюкозы и инсулина в режиме реального времени, несомненно, заслуживает того, чтобы быть названным как один из последних прорывов в исследовании диабета. Система подачи инсулина в сочетании с системой мониторинга глюкозы действительно может революционизировать лечение диабета.
- Как гормоны мозга играют важную роль в регулировании диабета и метаболических функций
В течение долгого времени исследователи всего мира закрепляли свой взгляд на функциях мозговых гормонов в регулировании метаболизма и производства инсулина, что в действительности вызывает или предотвращает диабетическое состояние. Гипоталамус – центральная область мозга, которая ответственна в регулировании важнейших органических поведений и функций, таких как аппетит, потребление пищи и соответствующей скорости обмена веществ и массы тела.
- Ключевая роль пищеварительной системы в возникновении диабета
Роль бета-клеток печени и поджелудочной железы в производстве инсулина известна, она является основным фактором в порождении диабета, но в последнее время роль пищеварительной системы относительно метаболизма и диабета, открыла путь к новому подходу к сбою метаболизма и регулированию глюкозы крови. Связано это с хроническим воспалительным заболеванием кишечника или пищеварительного тракта, который способствует типичной устойчивости к инсулину при диабете 2 типа. Большинство больных диабетом 2 типа в основном страдает от устойчивости к инсулину, таким образом, это новое открытие – действительно один из видных последних прорывов в исследовании диабета.
- Новые данные о влиянии диабета в ухудшении функций мозга
Хотя диабет непосредственно никогда не связывался с ухудшением функции мозга, было замечено, что пожилые люди более уязвимы для диабетического состояния и как только у них развивается такое состояние, их функции мозга имеют тенденцию ухудшаться в более быстром темпе. Но поскольку диабет все более и более затрагивают людей младшей возрастной группы, становится очевидным, что ухудшающаяся функция мозга имеет некоторое отношение к диабетическому состоянию. Согласно результатам последнего исследования, диабет может значительно уменьшить кровообращение в мозге, а также может ослабить маленькие кровеносные сосуды в мозге, которые приводят к повреждению клеток. Таким образом люди с диабетом могут фактически быть более уязвимыми для ухудшения умственных функций, ответственных за повседневные жизненные задачи и выполнение других познавательных функций. Согласно исследователям, диабетики более уязвимы для Болезни Альцгеймера, слабоумия и других нервных расстройств, чем люди, которые не болеют диабетом.
- Новый прорыв в том, как инсулин работает на молекулярном уровне
В течение многих лет гормон инсулин является синонимом к лечению диабета, и все мы знаем, какую важную роль он играет в регулировании глюкозы крови и тем самым создавая здоровый обмен веществ, но никто не может иметь ни малейшего представления о том, какую функцию выполняет инсулин на молекулярном уровне внутри тела. Впервые команда исследователей могла предоставить нам подробности о том, как гормон инсулина связывается с поверхностью клеток, и таким образом создает путь для глюкозы через кровь, которая будет использоваться в качестве энергии позже, когда тело будет нуждаться в ней. Несомненно в глобальной борьбе против диабета эти молекулярные выводы о том, как на самом деле работает инсулин, может проложить путь к успешным результатам в лечении диабета.
- Открытие гормона бетатрофин
Это, пожалуй, самое яркое среди всех последних достижений в исследованиях диабета, которое удивило весь научный мир результатами в лечении диабета у мышей. Исследователи сделали революционное открытие, что гормон бетатрофин, может играть большую роль в повышении производительности бета-клетками гормона инсулина. Хотя эксперимент был выполнен только на мышах и еще осталось пройти тест на человеке, он может также быть самым существенным и революционным прыжком, чтобы найти окончательный препарат для лечения сахарного диабета.
- Пересадка здоровых клеток производящих инсулин в поджелудочной железе
Просто подумайте о ситуации, когда для того, чтобы излечить Ваш диабет, достаточно пересадить здоровые клетки производящие инсулин в Вашу поджелудочную железу, и таким образом Вы наконец заканчиваете долгие годы страдания от диабетического состояния. Это кажется удивительным и невероятным, не так ли? Да, такие вещи были сумасшедшими идеями врачей, но с новыми результатами исследования и открытия нового метода пересадки здоровых клеток в поджелудочной железе, это уже не просто идея, а вскоре может быть новаторской формулой в борьбе против диабета. Исследователи наконец обнаружили революционный метод клеточной трансплантации в поджелудочной железе.
- Роль нервной системы в производстве инсулина
Среди последних прорывов в исследовании диабета во всем мире этот – самый шокирующий, так так, что оно даже потрясло исследователей, которые работали над ним. Долгие годы предполагалось, что наши неврологические функции могут иметь некоторое влияние в порождении диабетического состояния, но до сих пор не было никакого существенного доказательства, чтобы утвердить это. Исследователи из Торонто в конце их новаторских исследований обнаружили, что наша нервная система может вызвать диабет. По словам исследователей, боль нейронов в поджелудочной железе, прежде всего дают сигналы в мозг, что ткань была повреждена и таким образом, постепенно начинается диабетическое состояние. Напротив, когда исследователи отключили сенсорные нервы в поджелудочной железе мышей, путем инъекции капсаицина, внезапно поджелудочная железа начала производить инсулин, и диабетическое состояние прошло. Поскольку один исследователь вставил затруднительные слова, что мыши, затронутые с диабетом внезапно, избавились от него.
- Искусственная Поджелудочная железа
После более чем десятилетних исследований в том, как устойчиво поставлять инсулин жертвам диабета, особенно кто страдает от инсулинозависимого диабета 1 типа, команда исследователей наконец придумала большое новшество, чтобы бороться с инсулинозависимым диабетом. Да, это великолепное открытие, которое сбило с толку научное сообщество с возобновленной надеждой и страхом, не является ничем другим, как искусственная поджелудочная железа. Поджелудочная железа ответственна за производство гормона инсулин, который регулирует глюкозу крови, и при диабете 1 типа клетки производящие инсулин в поджелудочной железе разрушаются, и следовательно пациент страдает от чрезвычайного диабетического состояния, приводящего к критическим осложнениям. Искусственная поджелудочная железа состоит из монитора глюкозы или датчика и инсулиновой помпы, для того, чтобы поставлять инсулин когда тело нуждается в нем. Эта технология может уменьшить типичные жизненные угрозы диабета 1 типа и критические состояния в значительной степени без необходимости пациентам проводить постоянный мониторинг по регулированию глюкозы в крови.
Источник
Сахарный диабет — одна из самых прогрессирующих болезней человечества. Введение инсулина для человека с сахарным диабетом 1 типа пока ничем не заменимая процедура. Но благодаря новым методам лечения, возможно, в скором времени удастся освободить людей из плена этой тяжелой болезни.

Новейшие исследования показали, что введение минимального числа заключенных в микрокапсулы клеток поджелудочной железы нормализовало уровень глюкозы в крови подопытных животных на 17 недель и более. Сахарный диабет без инсулина (без его самостоятельного введения) становится достижимой реальностью.
Число людей, живущих с сахарным диабетом, уже 425 миллионов. К 2045 году таких людей в мире станет более 630 миллионов.
Если человек с сахарным диабетом не борется с ним — не следит за состоянием уровня глюкозы в крови, не соблюдает диету и норму физической нагрузки, не использует необходимые лекарства, а при необходимости — инсулин, то его ждут крайне тяжелые осложнения, лишение нормального образа жизни и ранняя смерть.
Наиболее тяжелая форма болезни — сахарный диабет 1 типа. В этом случае у человека погибают бета-клетки в его поджелудочной железе и его организм теряет возможность производить собственный гормон инсулин. Без инсулина клетки организма не в состоянии нормально существовать, в частности, получать глюкозу из крови — в результате человек погибает.
Сахарный диабет I типа составляет до 10% всех случаев диабета.
Среди детей наиболее распространенным является именно сахарный диабет 1 типа. Всего на данный момент им страдают более 1 миллиона детей по всему миру.
Единственным опробованным, массовым и надежным способом жизни с сахарным диабетом 1 типа на сегодняшний день является инсулинотерапия. Только постоянный мониторинг уровня сахара в крови (с помощью глюкометра или систем постоянного мониторинга, вроде Freestyle Libre или Dexcom ), постоянные инъекции инсулина с помощью шприц-ручек или инсулиновых помп и учет съеденного — дают шанс человеку на полноценную жизнь.
Если человек с сахарным диабетом успешно осуществляет самоконтроль и ему удается проводить успешную инсулинотерапию, то его качество жизни ничем не отличается от обычной, и он сможет реализоваться наравне со всеми — чему свидетельствуют многие очень успешные люди — политики, ученые, спортсмены и актеры с сахарным диабетом.
Однако инсулинотерапия не восстанавливает физиологическую саморегуляцию, требует постоянных усилий со стороны человека и его близких и сохраняет постоянный риск опасных состояний — гипогликемии и сопутствующих сахарному диабету осложнений.
Уже несколько десятилетий ведется поиск альтернативных решений проблемы сахарного диабета 1 типа. Одно из них — создание «искусственной поджелудочной железы», которая самостоятельно контролирует уровень сахара в крови и вводит необходимые дозы инсулина (1,2).
Второй путь — пересадка донорской поджелудочной железы или её фрагментов; пересадка островков поджелудочной железы (с бета-клетками) от человека или животных а также попытки искусственного выращивания инсулин-продуцирующих клеток из стволовых клеток для их последующего ввода в организм.
Но этот путь до сих пор сталкивался с существенными сложностями. Пересадки от человека — из-за крайне малого числа донорского материала по сравнению с требуемым, высокой стоимости и большого числа иммунных реакций организма на пересажанный материал.
Пересадки островков поджелудочной железы от животных также сталкиваются с большим числом трудностей. Главные из которых: нефункционирование должным образом пересаженных клеток, иммунный ответ организма и опасность заражения человека (и человеческой популяции в целом) болезнями животных-доноров.
В частности, чтобы сохранить эффективность пересаженных клеток, человеку приходится принимать сильные иммуннодепрессанты, тем самым существенно снижая собственную защитную систему и подвергая свою жизнь большому риску.
Крайне недостаточное число материала для пересадки от человека (донорами могут быть только погибшие люди) и серьезная (к счастью, пока гипотетическая) опасность заразить человечество зооинфекцией в случае пересадки клеток от животных стимулируют разработку технологий создания тканеинженерных конструкций, замещающих работу островков поджелудочной железы. Клетки, которые должны выполнять функцию погибших бета-клеток человека, либо выделяются из донорского материала, либо выращиваются из различного типа стволовых клеток и «закрепляются» в специальных биокаркасах.
К сожалению, попытки выращивания работающих островковых клеток из различного типа стволовых клеток пока не привели к тому уровню успешности, когда полученные клетки можно было бы использовать для лечения сахарного диабета. Биоинженерные же работы с клетками доноров вполне успешны.
Например, решением части проблем клеточной трансплантации является технология заключения островков поджелудочной железы в микрокапсулы, которые и вводятся больному сахарным диабетом 1 типа. Технология микрокапсулирования помогает изолировать клетки островков поджелудочной железы доноров от иммунной системы пациента. При этом сами клетки должны как можно дольше сохранять жизнедеятельность (осуществлять свободный обмен питательными веществами и кислородом) и эффективно выполнять свою основную функцию — производить инсулин в ответ на повышение уровня глюкозы в крови.
Современные технологии позволяют производить такие микрокапсулы из биосовместимых и нетоксичных материалов. Различные группы ученых во многих странах пытаются усовершенствовать данный метод.
Одна из недавно решенных задач – это уменьшение числа вводимых микрокапсул. Дело в том, что ранее, в процессе микрокапсулирования островков поджелудочной железы, большая часть микрокапсул оставалась пустыми. Из-за этого значительно увеличился объем имплантируемого материала, что сильно увеличивало иммунную реакцию после имплантации.
Для разделения микрокапсул использовались магнитные наночастицы и созданный с помощью 3D-печати чип с микроканалами, который и разделял полученные ранее микрокапсулы на пустые и те, в которых находились островки поджелудочной железы. В результате общий объем имплантата снизился почти на 80%.
Очищенные имплантаты вводились подкожно крысам с сахарным диабетом 1 типа — в результате в течение более 17 недель уровень глюкозы в крови животных восстанавливался до нормогликемии (<200 мг / дл).
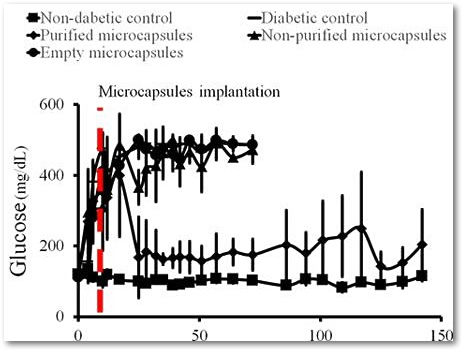
Уровень глюкозы в крови у подопытных крыс. Вверху: графики животных с введенными пустыми микрокапсулами (большие точки); с несортированными микрокапсулами (треугольники). Внизу: график животных с отобранными микрокапсулами (маленькие точки) и контрольный график уровня глюкозы у животных без сахарного диабета (квадраты).
Этот и подобные эксперименты дарят надежду миллионам больным сахарным диабетом на то, что в скором времени удастся совершить прорыв лечении одной из самых массовых болезней человечества.
Пока же больные сахарным диабетом 1 типа должны особо тщательно соблюдать процедуры инсулинотерапии, чтобы сохранить своё здоровье до массового внедрения новых технологий.
Поделиться / сохранить у себя:

ТЕМЫ: Биология Здоровье Человек Болезни Диета Продолжительность жизни
ЧИТАЙТЕ ТАКЖЕ:
Источник
Когда говорят о сахарном диабете 2 типа, ни у кого не вызывает сомнений, что речь идет о тяжелом и прогрессирующем заболевании, связанном с развитием как микрососудистых, так и макрососудистых осложнений. Развитие осложнений связывают в первую очередь с хронической гипергликемией, что было убедительно доказано в ходе длительных крупномасштабных исследований, в том числе UKPDS (United Kingdom Prospective Diabetes Study). К значительным факторам риска развития сосудистых осложнений заболевания также относится изменение показателей липидного спектра и уровня артериального давления. Очевидно, что единственным способом предотвратить или отсрочить развитие этих грозных осложнений является поддержание показателей уровней глюкозы крови, максимально приближенных к физиологическим без повышения риска гипогликемии и без ущерба для качества жизни больных. В настоящее время, по рекомендациям Американской диабетической ассоциации, основной целью лечения сахарного диабета является снижение гликированного гемоглобина (HbA1c) до уровня <7%, а Европейской группой политики в области диабета рекомендован еще более жесткий критерий компенсации сахарного диабета – уровень гликированного гемоглобина <6,5%. Однако у большинства пациентов не удается добиться компенсации заболевания [13]. В Российской Федерации 74,8% больных сахарным диабетом 2 типа не достигают целевых значений HbA1c <7% [Ю.И. Сунцов, И.И. Дедов, М.В. Шестакова, 2008] и несмотря на наличие разнообразных групп сахароснижающих препаратов 57,4% пациентов с сахарным диабетом 2 типа имеют уровень гликозилированного гемоглобина >8% [Ю.И. Сунцов, И.И. Дедов, 2006] (рис. 1). Поэтому ученые во всем мире занимаются поиском новых лекарственных средств для более эффективного управления этим заболеванием.
В последние годы значительно большее внимание со стороны ученых всего мира уделяется изучению роли гормонов желудочно–кишечного тракта – инкретинов в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека.
В настоящее время в научной литературе имеются многочисленные убедительные данные, свидетельствующие о важной роли таких гормонов желудочно–кишечного тракта, как глюкагоноподобный пептид 1 (ГПП–1) и глюкозо–зависимый–инсулинотропный полипептид или желудочный ингибирующий пептид (ГИП). Эти гормоны получили название инкретины. А их действие, приводящее к усилению глюкозозависимой секреции инсулина b–клетками поджелудочной железы, было названо «эффектом инкретина».
Интересно отметить, что «эффект инкретина» был впервые описан двумя независимыми исследовательскими группами (McIntyre, Elrick) еще в 1964 году, и характеризует действие пептидных гормонов, которые секретируются К– и L–клетками кишечника в ответ на прием пищи [4–6]. Известно, что ГИП секретируется энтероэндокринными К–клетками двенадцатиперстной кишки и проксимального отдела тощей кишки, а продукция ГПП–1 осуществляется преимущественно L–клетками подвздошной кишки и толстого кишечника.
Период полужизни циркулирующего, биологически активного ГПП–1, к сожалению, меньше, чем 2 минуты. Такой короткий период полужизни ГПП–1 в плазме обусловлен протеазной активностью фермента дипептидил пептидаза 4 (ДПП–4).
В исследованиях было также установлено, что действие ГПП–1 не ограничивается только усилением экзоцитоза секреторных гранул из b–клеток, содержащих инсулин. ГПП–1 влияет также и на a–клетки поджелудочной железы, подавляя секрецию глюкагона, что, в свою очередь, контролирует постпрандиальный уровень гликемии [9–12].
Определенный интерес представляют также данные о том, что эффект действия ГПП–1 проявляется путем мощного усиления, подобно «взрыву» секреции инсулина. Однако введение ГПП–1 не влияет на частоту и амплитуду пульсовой секреции инсулина [Porksen W., 1998].
Имеются доказательства, что ГПП–1 действует как вещество, резко повышающее чувствительность b–клеток к глюкозе. При достижении максимально близких к нормогликемии показателей у больных сахарным диабетом 2 типа в значительной степени увеличивается риск развития гипогликемий. В этой связи уместно привести высказывание известного американского диабетолога Филлипа Крейера: «Если бы не разрушительные последствия гипогликемии, лечение сахарного диабета было бы очень легким» [P.E. Cryer, 1999].
В основном считается, что гипогликемия развивается за счет единственного фактора риска – увеличения уровня инсулина. Это может наблюдаться при слишком большой дозе инсулина или пероральных сахароснижающих препаратов, слишком низком потреблении глюкозы с пищей, при повышенной утилизации глюкозы тканями (например, при чрезмерной физической нагрузке), а также повышенной чувствительности к инсулину. Следует помнить, что гипогликемия сама по себе вызывает долговременные и серьезные проблемы при развитии тяжелых эпизодов, связанные в первую очередь с нарушением познавательной (когнитивной) функции.
Поэтому чрезвычайно клинически важным следствием зависимости эффектов ГПП–1 от концентрации глюкозы в крови, конечно, является то, что ГПП–1 не может вызвать развитие выраженной гипогликемии (кроме случаев одновременного применения с препаратами сульфонилмочевины, что требует просто снижения дозы последней группы препаратов). Это основано на том, что действие инкретинов на секрецию инсулина и глюкагона напрямую зависит от концентрации глюкозы в плазме крови, и прекращается при снижении уровня глюкозы менее 3,0 ммоль/л.
Помимо этого, недавно было показано, что ГПП–1 способен ингибировать апоптоз b–клеток. В связи с тем, что нормальное количество b–клеток поддерживается равновесием процессов апоптоза и пролиферации, эти данные представляют огромный интерес и открывают возможность того, что ГПП–1 может оказаться эффективным при патологических состояниях, связанных с усиленной гибелью b–клеток. Все это позволяет предположить, что ГПП–1 может быть способным стимулировать образование новых b–клеток (неогенез) у пациентов с сахарным диабетом 2 типа и недостаточным количеством функционирующих клеток (хотя к настоящему времени еще не выяснено, насколько этот процесс выражен у человека). Таким образом, не исключено, что новые методы терапии, основанные на действии инкретинов, смогут остановить прогрессирующее снижение массы функционирующих b–клеток при развитии дефицита секреции инсулина, что, в свою очередь, существенно замедлит прогрессирование заболевания.
Особый интерес для практической медицины представляют данные, касающиеся изучения секреции ГИП и ГПП–1 при сахарном диабете 2 типа.
Так, в исследовании Toft–Nielsen обнаружили, что уровни ГИП натощак у больных сахарным диабетом 2 типа близки к нормальным значениям. В то же время эти авторы, изучая секрецию ГПП–1 у больных сахарным диабетом 2 типа, выявили существенные нарушения этого энтерогормона при данном заболевании.
При сравнении секреции инсулина в ответ на пероральную и внутривенную нагрузку глюкозой при условии одинаковой концентрации глюкозы оказалось, что повышение секреции инсулина в ответ на пероральное введение у здоровых лиц достоверно выше, чем при сахарном диабете 2 типа [Nauck, 1986]. Необходимо напомнить, что у здоровых лиц ГПП–1 и ГИП обеспечивают 60–70% общего инсулинового ответа после приема пищи. Однако при сахарном диабете 2 типа эффект инкретина присутствует, но значительно снижен по сравнению со здоровыми людьми [9].
Говоря о нарушении эффекта инкретина при сахарном диабете 2 типа, важно подчеркнуть, что при этом заболевании секреция ГПП–1 снижена на 20–30% при сохранении в целом его инсулиностимулирующего действия. В то же время следует отметить, что секреция ГИП не меняется, однако установлено снижение его стимулирующего влияния на b–клетки поджелудочной железы [7,8].
Причины этих нарушений окончательно не установлены, хотя большинство исследователей склоняется к тому, что нарушение секреции ГПП–1, очевидно, является следствием сахарного диабета 2 типа.
В последнее десятилетие благодаря фундаментальным и клиническим исследованиям развилось новое и перспективное направление в лечении сахарного диабета 2 типа, основанное на использовании эффекта инкретина. Поскольку период полужизни ГПП–1 очень короткий, в клинической практике его невозможно использовать в качестве натурального препарата. В связи с этим было предложено ингибирование фермента ДПП–4, разрушающего естественные инкретины организма.
Первым ингибитором, который был создан, явился ситаглиптин (Янувия). Его действие основано на подавлении активности ДПП–4 с высокой степенью специфичности и повышении уровня собственного ГПП–1 за счет блокады его разрушения указанным ферментом. Причем ингибирование активности ДПП–4 проявляется достаточно быстро и отмечается уже через 30 минут после перорального применения, а продолжительность действия составляет около 24 часов. Поскольку действие инкретинов является глюкозозависимым, то и действие ситаглиптина (Янувии) является глюкозозависимым, т.е. препарат действует только при повышенном уровне глюкозы крови.
В настоящее время Янувия зарегистрирована в Российской Федерации и рекомендована для лечения пациентов с сахарным диабетом 2 типа как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами.
Эффективность ситаглиптина при его использовании в качестве монотерапии определена в целом ряде работ. В 12–недельном исследовании, в котором приняли участие пациенты с неудовлетворительным контролем диабета, отмечалось снижение уровня гликированного гемоглобина (HbA1c), исходно равного 7,8%, по отношению к плацебо на 0,77% [12]. Таким образом, у пациентов с сахарным диабетом 2 типа с неудовлетворительной компенсацией монотерапия Янувией приводила практически к целевым уровням HbA1c.
Помимо этого, эффективность ситаглиптина в комбинированной терапии с другими пероральными сахароснижающими препаратами была наиболее детально изучена в ряде крупных международных исследований.
Известно, что сахарный диабет 2 типа характеризуется нарушением регуляции гомеостаза глюкозы в системе печень – периферические ткани –
β–клетки поджелудочной железы. Основываясь на том, что комбинированная терапия метформином и ситаглиптином способна оказывать положительное влияние на все патофизиологические дефекты развития заболевания, на протяжении 2 лет проводилось исследование по изучению эффективности комбинации метформина и ситаглиптина в качестве терапии первой линии [1].
В данном исследовании пациенты получали комбинацию 100 мг ситаглиптина и 2000 мг метформина в сутки. Адекватность контроля гликемии оценивалась по изменению уровня HbA1c относительно исходного через 1 и 2 года терапии. В результате через 1 год терапии среднее снижение уровня HbA1c относительно исходного составило 1,8%. При продолжении исследования (n=105; исходный уровень HbA1c в данной группе пациентов – 8,6%) среднее снижение уровня HbA1c к концу 2 года терапии составило 1,7% (рис. 2). Среди пациентов, получавших 100 мг ситаглиптина и 1000 мг метформина в сутки, среднее снижение уровня HbA1c составило 1,4% (n=147 через 1 год и n=96 через 2 года). В то же время необходимо уточнить, что у пациентов, получавших ситаглиптин в монотерапии в дозе 100 мг 1 раз в сутки, среднее снижение уровня HbA1c относительно исходных значений составило 0,8% в конце 1 года (n= 106) и 1,2% в конце 2 года терапии (n=50).
Далее при анализе подгруппы пациентов, имевших исходно высокие значения HbA1c, комбинация 100 мг ситаглиптина и 2000 мг метформина в сутки продемонстрировала более выраженное снижение средних значений HbA1c относительно исходного уровня, составивших в конце 1 года терапии при исходных значениях HbA1c 10% и более – 3,1%, 9–10% – 2,2%, 8–9% – 1,7% и менее 8% – 1,0%. Через 2 года терапии аналогичный показатель у больных, имевших исходный уровень HbA1c 10% и более, составил 3,3%, 9–10% – 2,5%, 8–9% – 1,6% и менее 8% – 0,9% (рис. 3).
Проведено также рандомизированное двойное слепое исследование по оценке эффективности ситаглиптина (Янувия) в дополнение к метформину и/или препаратам сульфонилмочевины. В нем в течение 24 недель изучалась эффективность и безопасность добавления ситаглиптина у 441 пациента с сахарным диабетом 2 типа в стадии декомпенсации (HbA1c от 7,5 до 10,5%) к терапии либо комбинацией препарата сульфонилмочевины (глимепирида) и метформина, либо к монотерапии препарата сульфонилмочевины (глимепирида). При анализе работы отмечалось статистически достоверное снижение уровня HbA1c по сравнению с плацебо (0,9%) при дополнительном назначении с глимепиридом и метформином и на 0,6% при дополнительном назначении с глимепиридом (рис. 4). Однако необходимо отметить, что в данном исследовании общая частота побочных эффектов при применении ситаглиптина была выше по сравнению с группой плацебо, в том числе чаще отмечались случаи развития эпизодов гипогликемии (12,2% в группе приема ситаглиптина по сравнению с 1,8% в группе приема плацебо). Эпизоды гипогликемии развивались при комбинированном применении с препаратами сульфонилмочевины. Поэтому для снижения риска развития гипогликемии может потребоваться уменьшение дозы препаратов сульфонилмочевины.
Учитывая данные проведенных исследований, необходимо отметить, что терапия ситаглиптином у большинства больных хорошо переносится. В целом частота развития эпизодов гипогликемии была сопоставимой либо существенно ниже по сравнению с контрольными группами. Среди наиболее часто встречающихся побочных эффектов отмечались заложенность носа, сухость во рту, головные боли, инфекционные заболевания верхних дыхательных путей и мочевыделительной системы (по сравнению с плацебо разница в среднем составляет от 0,1 до 1,5%). Следует также отметить, что к преимуществам сахароснижающей терапии ситаглиптином относится нейтральное влияние на массу тела и возможность использования препарата в пероральной форме – в отличие от инсулинотерапии и аналогов ГПП–1 [10].
Назначение ситаглиптина (Янувии) можно рекомендовать следующим пациентам с сахарным диабетом 2 типа:
• пациенты с уровнем HbA1c выше 7% (или гликемии натощак выше 6,1 ммоль/л), получающие метформин или сульфонилмочевину, или комбинацию этих препаратов
• пациенты с впервые выявленным сахарным диабетом 2 типа – в виде монотерапии или стартовой терапии в комбинации с метформином
• пациенты, по возможности, в ранней фазе заболевания, при которой количество
β–клеток снижено еще незначительно, с целью защиты
β–клеток
• пациенты с проблемами веса:
0 с избыточным весом
0 с нормальным весом, но с значительной прибавкой веса (более 2 кг за первый год) на фоне приема других пероральных сахароснижающих препаратов
• пациенты с более высокой опасностью развития гипогликемии на фоне приема сульфонилмочевины:
0 пациенты, которые нерегулярно питаются,
0 худые; одинокие; пожилые пациенты,
0 водители автотранспорта,
0 пациенты, работающие с механизмами.
Таким образом, есть надежда, что в недалеком будущем мы сможем обеспечить более хороший гликемический контроль у пациентов с сахарным диабетом 2 типа, снижая уровень гликированного гемоглобина, уменьшая суточные колебания глюкозы, снижая риск развития гипогликемий и, наконец, действительно обеспечивая достойное качество жизни больных, реально управляя этим тяжелым и пока неизлечимым заболеванием с помощью ситаглиптина (Янувии), первого представителя новой группы сахароснижающих препаратов, ингибиторов ДПП–4.
Литература
1. Qi DS., et al. Two year treatment with sitagliptin and initial combination therapy of sitagliptin and metformin provides substantial and durable glycemic control in patients with type 2 diabetes. EASD Abstract August, 2008
2. Arjona Ferreira, J., et al. Triple combination therapy with sitagliptin, metformin, and rosiglitazone improves glycemic control in patients with type 2 diabetes. EASD Poster August, 2008
3. А.С. Аметов. Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов, РМЖ, №26, 2006
4. McIntyre N, Holdsworth CD, Turner DS. New interpretation of oral glucose tolerance. Lancet. 1964; 41:20–21
5. Creutzfeldt W. The (pre–) history of the incretin concept. Regul Pept. 2005;128:87–91
6. Elrick H. Plasma insulin response to oral and intravenous glucose administration. J Clin Endocrinol Metab. 1964; 1076–1082.
7. Ehses JA, Casilla VR, Doty T, et al. Glucose–dependent insulinotropic polypeptide promotes beta–cell survival via cyclic adenosine monophosphate–mediated caspase–3 inhibition and regulation of p–38 mitigen–activated protein kinase. Endocrinology. 2003;144:4433–4445
8. Toft–Nielsen M–B, Damholt MB, Madsbad S. et al. Determinats of the impaired secretion of glucagon–like peptide–1 in type 2 diabetic patients. J Clin Endocrinol Metab. 2001;86:3717–3723
9. Nauck M, Stockmann F, Ebert R, Creutzfeldt W. Reduced incretin effect in type 2 (non–insulin–dependent) diabetes. Diabetologia. 1986;29:46–52
10. Романцова Т.И. Ингибитор дипептидилпептидазы– 4–ситаглиптин: новые возможности терапии сахарного диабета 2 типа. Ожирение и метаболизм, 4(9), 2006
11. Maegawa H., et al. Sitagliptin added to ongoing treatment with pioglitazone study up–to 52 weeks in Japanese patients with T2DM. EASD Poster August, 2008
12. Scott RS et al. Poster presented at the 41st Annual Meeting of the European Association for the Study of Diabetes (EASD), Athens, Greece, September 12–15, 2005
Источник
