Клеточные технологии и сахарный диабет

Сурен Закиян, Сергей Медведев
«Наука из первых рук» №1(61), 2015
Сурен Минасович Закиян — доктор биологических наук, профессор, заведующий лабораторией эпигенетики развития Института цитологиии генетики СО РАН, заведующий лабораторией молекулярной и клеточной медицины Новосибирского научно-исследовательского института патологии кровообращения им. академика Е. Н. Мешалкина, заведующий лабораторией стволовой клетки Института химической биологии и фундаментальной медицины СО РАН. Автор и соавтор 215 научных работ, 5 патентов и 3 монографий. |
Сергей Петрович Медведев — кандидат биологических наук, старший научный сотрудник Института цитологии и генетики СО РАН и Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), ведущий научный сотрудник Новосибирского научно-исследовательского института патологии кровообращения им. академика Е. Н. Мешалкина. Автор и соавтор 14 научных работ. |
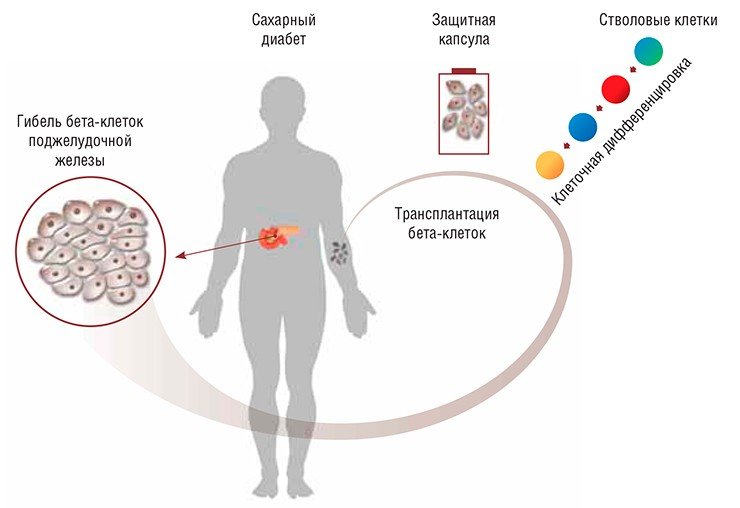
В работах, попавших в 2014 г. в прорывы по версии журнала Science, ученым удалось значительно продвинуться в разработке альтернативной терапии сахарного диабета 1-го типа, суть которой состоит в трансплантации больным так называемых бета-клеток поджелудочной железы, вырабатывающих гормон инсулин. До сих пор такие клетки получали из тканей эмбрионов или брали у доноров посмертно. Однако их использование сталкивалось с рядом проблем, от тканевой несовместимости до этических. Выход, предложенный учеными, заключается в пересадке больным зрелых бета-клеток, полученных в лабораторных условиях из стволовых недифференцированных клеток самого пациента либо обычных соматических клеток путем их «перепрограммирования». Для широкого применения этой технологии требуется решить проблему защиты трансплантата, поскольку диабет 1-го типа — это аутоиммунное заболевание, и новые бета-клетки будут также подвергаться атакам иммунной системы.
Сахарный диабет — самое распространенное эндокринное заболевание в мире: по данным Международной федерации диабета сегодня им страдает более 300 млн человек. Болезнь не обошла и семью Дугласа Мелтона, руководителя одной из исследовательских групп, занимающихся разработкой клеточной терапии диабета. Их работы вошли в список наиболее выдающихся научных достижений 2014 г. по версии журнала Science.
Сахарный диабет — болезнь, характеризующаяся стойким увеличением в крови концентрации глюкозы, — сегодня входит в тройку самых распространенных видов заболеваний. При диабете 2-го типа бета-клетки островков Лангерганса в поджелудочной железе вырабатывают пептидный гормон инсулин, который регулирует уровень глюкозы в крови, но ткани организма теряют чувствительность к нему. Этот наиболее распространенный (до 80–90% случаев) тип сахарного диабета, который называют еще инсулинонезависимым, развивается преимущественно в пожилом возрасте и характеризуется относительно легким течением.
При диабете 1-го типа наблюдается аутоиммунное поражение бета-клеток поджелудочной железы, вырабатывающих гормон инсулин. Такой тип диабета приводит к полной пожизненной зависимости от инъекций инсулина — на данный момент это практически единственный способ терапии этого тяжелого заболевания. Больной должен постоянно следить за уровнем глюкозы в крови и в зависимости от «скачков» уровня глюкозы самостоятельно корректировать дозы инсулина. При этом в любом случае у больного развиваются осложнения: дисфункция почек и сердечно-сосудистой системы, поражение глаз (диабетическая ретинопатия), некротическое поражение тканей. Результатом является существенное снижение качества жизни больных, а зачастую инвалидность и ранняя смерть.
Говоря об альтернативной возможности терапии сахарного диабета, надо упомянуть о существовании достаточно успешной практики пересадки донорских бета-клеток. Их получают из тканей эмбрионального происхождения или берут у доноров посмертно. После такой трансплантации больной на несколько лет становится независимым от инъекций инсулина. Проблемы такого вида терапии связаны с качеством и количеством донорского материала, не говоря уже о тканевой несовместимости реципиента и донора. Ведь после пересадки больные вынуждены принимать препараты, подавляющие активность иммунной системы, к тому же через какое-то время все равно происходит отторжение трансплантата. Еще одно препятствие — проблемы этического характера, связанные с использованием тканей эмбрионов.
Выход из ситуации в принципе есть: бета-клетки поджелудочной железы можно получать in vitro (в лабораторных условиях) из клеточных культур. Их источником могут быть плюрипотентные стволовые клетки человека, т. е. «первичные» недифференцированные клетки, из которых происходят все клетки наших органов и тканей. Для получения бета-клеток можно использовать как стволовые клетки эмбрионов, так и индуцированные плюрипотентные стволовые клетки, которые получают из обычных соматических клеток взрослого человека путем их «перепрограммирования».

Технологии получения индуцированных плюрипотентных стволовых клеток известны и достаточно хорошо разработаны. Но вот получить из них зрелые бета-клетки гораздо сложнее, так как для этого необходимо буквально в чашке Петри воспроизвести сложнейшие процессы, происходящие во время эмбрионального развития человека, используя сигнальные молекулы и химические соединения, направляющие развитие клеток в нужную сторону.
В список выдающихся научных исследований прошлого года, опубликованный журналом Science, как раз и вошли работы двух исследовательских групп: из Гарвардского института стволовых клеток (США) и Медицинской школы Массачусетского университета в Вустере (США) под руководством Д. Мелтона и из Университета провинции Британская Колумбия (Канада) и компании BetaLogics (США) под руководством Т. Кифера, посвященные технологиям получения in vitro бета-клеток поджелудочной железы (Pagliuca et al., 2014; Rezania et al., 2014). Взяв в качестве исходного материала стволовые клетки человеческого эмбриона, в итоге ученые получили клетки, проявляющие все основные качества бета-клеток. То есть в них «работали» определенные гены и присутствовали специфические белки, так что эти клетки были способны продуцировать инсулин в ответ на присутствие глюкозы. Пересаженные лабораторным мышам из чистой линии, служащей экспериментальной моделью сахарного диабета, эти клетки нормально функционировали и компенсировали первоначальное отсутствие инсулина!

Огромное преимущество этого метода в том, что с его помощью можно получать функционирующие бета-клетки в довольно большом количестве. В финале процесса из одного флакона для культивирования объемом 0,5 л можно получить до 300 млн клеток — этого числа вполне достаточно, чтобы компенсировать недостающий инсулин у одного человека весом около 70 кг. Или для проведения скрининга среди 30 тыс. отдельных химических соединений — потенциальных лекарственных веществ, если использовать клетки не по «прямому назначению», а для фармакологических исследований.
Безусловно, описанные технологии нуждаются в совершенствовании. В частности, необходима разработка детальных протоколов получения бета-клеток из индуцированных плюрипотентных стволовых клеток. Это позволит не только в любой период жизни пациента и практически из любых клеток его собственного организма при необходимости получить необходимое количество бета-клеток, но и разрешит проблему иммунологической несовместимости донора и реципиента.
Однако остается другая проблема: поскольку диабет 1-го типа — это аутоиммунное заболевание, то новые бета-клетки будут опять атакованы иммунной системой, как когда-то свои «родные» клетки пациента. Поэтому пересаженные клетки надо научиться защищать! Только в этом случае подобное лечение может стать доступным и широко применимым, ведь использование иммунодепрессантов оправдано только в самых тяжелых случаях.
Сейчас разрабатываются разные варианты подобной защиты. Например, можно покрыть клетки специальным гидрогелем, однако в этом случае их будет гораздо труднее удалить из организма при необходимости. К тому же пока не существует способа воспрепятствовать их инкапсуляции (заключению в соединительнотканную оболочку) подобно другим чужеродным телам в организме, что перекроет пересаженным клеткам приток питательных веществ. Сейчас идет поиск химических веществ, пригодных для изготовления гидрогеля, который не будет вызывать такого эффекта.
Другое решение предложили конкуренты команды Мелтона — американская компания ViaCyte. Суть его в том, чтобы поместить пул незрелых бета-клеток внутрь тела в биологически совместимой оболочке: предполагается, что предшественники бета-клеток будут там постепенно созревать и успешно функционировать. Такое устройство уже создано; более того, в компании уже запустили первый этап клинических испытаний. Но хотя результаты аналогичных исследований на животных выглядят многообещающе, есть опасения относительно эффективности этого способа.
В любом случае, уже сейчас имеющиеся технологии внушают надежду, что проблема лечения сахарного диабета будет в скором времени решена. Использование бета-клеток, произведенных из стволовых клеток пациентов, даже при условии постоянного приема иммунодепрессантов может стать огромным облегчением для больных тяжелыми формами диабета, которые постоянно сталкиваются с опасными для жизни изменениями уровня сахара в крови.
Литература:
1. Pagliuca F. W., Melton D. A. How to make a functional β cell // Development. 2013. V. 140. № 12. P. 2472–2483. DOI: 10.1242/dev.093187.
2. Pagliuca F. W., Millman J. R., Gürtler M. et al. Generation of functional human pancreatic β cells in vitro // Cell. 2014. V. 159. № 2. P. 428–439. DOI: 10.1016/j.cell.2014.09.040.
3. Rezania A., Bruin J. E., Arora P. et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells // Nat. Biotechnol. 2014. V. 32. № 11. P. 1121–1133. DOI: 10.1038/nbt.3033.
4. Ledford H. Stem-cell success poses immunity challenge for diabetes // Nature. 2014. V. 514. № 7522. P. 281. DOI: 10.1038/514281a.
Источник
Сахарный диабет является широко распространенным и очень опасным заболеванием, чреватым многими тяжелыми осложнениями. Суть заболевания состоит в повышении концентрации глюкозы в крови, которая не усваивается в достаточном количестве клетками организма. У многих больных диабетом развивается постоянная гипергликемия, которая приводит к таким недугам, как сердечные болезни, прогрессирующий атеросклероз сосудов, поражения нервов, слепота и почечная недостаточность. Многие диабетики становятся инвалидами из-за поражения сосудов нижних конечностей, так называемой «диабетической стопы». При сахарном диабете нарушается кровоток в мелких сосудах и капиллярах, и сосудистые осложнения наблюдаются при всех формах сахарного диабета и практически у всех больных. И это резко снижает качество жизни больных, обрекая их на страдания.
Проблема сахарного диабета 1 типа в том, что поврежденная поджелудочная железа не вырабатывает гормон инсулин, контролирующий уровень сахара в крови, в достаточном количестве, что вызывает сильнейшую слабость, часто резкое похудение, сильное чувство голода. При данном типе диабета имунные клетки, которые должны оборонять организм от микробов, поражают производящие инсулин клетки поджелудочной железы, так называемые бета-клетки, т. к. ошибочно принимает их за чужеродные. В результате выработка инсулина снижается, и организм теряет способность извлекать из пищи энергию. Глюкоза не может больше проникать в клетки, где она необходима, и вместо этого накапливается в крови, поражая внутренние органы. В традиционном лечении этого типа диабета практикуется постоянное введение препаратов инсулина.
При диабете 2 типа, в отличие от 1-го, инсулин клетками поджелудочной железы вырабатывается, но не воспринимается органами и тканями организма, они как бы теряют к нему чувствительность. Данный тип сахарного диабета часто является результатом избыточного веса. Традиционное лечение в этом случае состоит в снижении уровня глюкозы в крови и предполагает прием сахаропонижающих препаратов, а также лекарств, улучшающих кровообращение в периферических сосудах. При сахарном диабете обоих типов назначают также физические нагрузки и диетотерапию. Не смотря на большой выбор препаратов, их эффективность в лечении диабета, к сожалению, недостаточна.
Очевидно, что для эффективного лечения диабета 1 типа необходимы методы, которые боролись бы не с симптомами, а с причиной, т. е. помогли бы восстановить способность поджелудочной железы больного вырабатывать собственный инсулин.
Применение регенеративных, в том числе клеточных, технологий делает это возможным. При трансплантации стволовых клеток костного мозга в пораженную поджелудочную железу происходит своего рода «превращение» этих клеток в группы клеток, так называемых бета-клеток, продуцирующих инсулин, количество которых снижено в поджелудочной железе больных диабетом 1 типа.
Людмила А. ощущала слабость практически постоянно, даже в покое. А физические нагрузки, даже небольшие, вообще переносила крайне тяжело: обильная потливость, слабость такая (по ощущениям больной), что подгибались ноги: Ноги Людмилы были усеяны маленькими язвочками, поэтому обувь (даже летнюю — босоножки) она могла носить только надевая плотный хлопчатобумажный носок, и даже при этом ношение обуви было мукой. Диагноз Людмилы, с которым она попала в клинику «Реметэкс» — диабет 1 типа. После прохождения курса клеточной терапии, которую разработала компания «Реметэкс», сама Людмила описывает свое состояние следующим образом. » Первые улучшения я ощутила примерно через месяц, а может и раньше. Стала постепенно уменьшаться слабость. Затем, месяца через 2, появилась какая-то забытая мною давно энергия, жизненные силы. Через 3 месяца начали исчезать язвочки на ногах, через 5 месяцев после окончания курса клеточной терапии я смогла одевать босоножки без носка, а потом, когда лето закончилось, и другую обувь. Сейчас ноги абсолютно чистые, я забыла, как ощущались те давние боли. По результатам анализов крови, которые я делала после прохождения лечения регулярно, содержание сахара в крови, конечно, не в норме, но постоянно приближалось к ней. Этим, вероятно, и обусловлено более чем существенное уменьшение дневной дозы инсулина. Если до лечения моя дневная доза инсулина была 56-60 единиц в сутки, то сейчас, по прошествии почти 2-х лет после прохождения курса лечения, суточная доза составляет 13-16 единиц, и она остается почти год стабильной. В настоящее время я активно работаю, с охотой провожу время на своем садовом участке и чувствую себя хорошо«.
Для наиболее эффективного лечения диабета 1 типа необходимо также влиять на причины. Целесообразно помочь клеткам, не реагирующим на инсулин, используя клеточные трансплантаты, способные «сливаться» с дефектными клетками и передавать им генетический материал, ответственный за исправление этой проблемы. Предположительно, использование эндотелиальных прогениторных клеток, гемопоэтических клеток костного мозга, стромальных (мезенхимальных) клеток костного мозга и жировой ткани может увеличить количество периферических рецепторов к инсулину, а следовательно, увеличить чувствительность тканей организма к нему. Помимо этого существенно улучшается состояние периферических сосудов и кровообращение в них, что способствует частичному или полному снятию проблемы сосудистых осложнений и связанных с ними заболеваний. Многие больные, прошедшие курс клеточной терапии, смогли снизить количество потребляемых сахаропонижающих лекарств, или от инсулина, который они были вынуждены вводить себе до этого, а в некоторых случаях даже вовсе отказаться от поддерживающей терапии.
Совмещение клеточных технологий с традиционными классическими методами лечения диабета дает многократное увеличение эффективности в лечении этого опасного заболевания и дает надежду на возможность полного излечения от диабета в будущем.
Записаться на прием в нашу клинику Вы можете по телефону: (495) 68-12345.
Ведущие диабетологи и биотехнологии всегда рады Вам помочь.
Источник
![]()
: 30 Мар 2015 , Наша Арктика , том 61,
№1
В работах, попавших в 2014 г. в прорывы по версии журнала Science, ученым удалось значительно продвинуться в разработке альтернативной терапии сахарного диабета 1-го типа, суть которой состоит в трансплантации больным так называемых бета-клеток поджелудочной железы, вырабатывающих гормон инсулин. До сих пор такие клетки получали из тканей эмбрионов или брали у доноров посмертно. Однако их использование сталкивалось с рядом проблем, от тканевой несовместимости до этических. Выход, предложенный учеными, заключается в пересадке больным зрелых бета-клеток, полученных в лабораторных условиях из стволовых недифференцированных клеток самого пациента либо обычных соматических клеток путем их «перепрограммирования». Для широкого применения этой технологии требуется решить проблему защиты трансплантата, поскольку диабет 1-го типа – это аутоиммунное заболевание, и новые бета-клетки будут также подвергаться атакам иммунной системы.
Сахарный диабет – самое распространенное эндокринное заболевание в мире: по данным Международной федерации диабета сегодня им страдает более 300 млн человек. Болезнь не обошла и семью Дугласа Мелтона, руководителя одной из исследовательских групп, занимающихся разработкой клеточной терапии диабета. Их работы вошли в список наиболее выдающихся научных достижений 2014 г. по версии журнала Science.
Сахарный диабет – болезнь, характеризующаяся стойким увеличением в крови концентрации глюкозы, – сегодня входит в тройку самых распространенных видов заболеваний. При диабете 2-го типа бета-клетки островков Лангерганса в поджелудочной железе вырабатывают пептидный гормон инсулин, который регулирует уровень глюкозы в крови, но ткани организма теряют чувствительность к нему. Этот наиболее распространенный (до 80—90 % случаев) тип сахарного диабета, который называют еще инсулинонезависимым, развивается преимущественно в пожилом возрасте и характеризуется относительно легким течением.
 При диабете 1-го типа наблюдается аутоиммунное поражение бета-клеток поджелудочной железы, вырабатывающих гормон инсулин. Такой тип диабета приводит к полной пожизненной зависимости от инъекций инсулина – на данный момент это практически единственный способ терапии этого тяжелого заболевания. Больной должен постоянно следить за уровнем глюкозы в крови и в зависимости от «скачков» уровня глюкозы самостоятельно корректировать дозы инсулина. При этом в любом случае у больного развиваются осложнения: дисфункция почек и сердечно-сосудистой системы, поражение глаз (диабетическая ретинопатия), некротическое поражение тканей. Результатом является существенное снижение качества жизни больных, а зачастую инвалидность и ранняя смерть.
При диабете 1-го типа наблюдается аутоиммунное поражение бета-клеток поджелудочной железы, вырабатывающих гормон инсулин. Такой тип диабета приводит к полной пожизненной зависимости от инъекций инсулина – на данный момент это практически единственный способ терапии этого тяжелого заболевания. Больной должен постоянно следить за уровнем глюкозы в крови и в зависимости от «скачков» уровня глюкозы самостоятельно корректировать дозы инсулина. При этом в любом случае у больного развиваются осложнения: дисфункция почек и сердечно-сосудистой системы, поражение глаз (диабетическая ретинопатия), некротическое поражение тканей. Результатом является существенное снижение качества жизни больных, а зачастую инвалидность и ранняя смерть.
Говоря об альтернативной возможности терапии сахарного диабета, надо упомянуть о существовании достаточно успешной практики пересадки донорских бета-клеток. Их получают из тканей эмбрионального происхождения или берут у доноров посмертно. После такой трансплантации больной на несколько лет становится независимым от инъекций инсулина. Проблемы такого вида терапии связаны с качеством и количеством донорского материала, не говоря уже о тканевой несовместимости реципиента и донора. Ведь после пересадки больные вынуждены принимать препараты, подавляющие активность иммунной системы, к тому же через какое-то время все равно происходит отторжение трансплантата. Еще одно препятствие – проблемы этического характера, связанные с использованием тканей эмбрионов.
Выход из ситуации в принципе есть: бета-клетки поджелудочной железы можно получать in vitro (в лабораторных условиях) из клеточных культур. Их источником могут быть плюрипотентные стволовые клетки человека, т. е. «первичные» недифференцированные клетки, из которых происходят все клетки наших органов и тканей. Для получения бета-клеток можно использовать как стволовые клетки эмбрионов, так и индуцированные плюрипотентные стволовые клетки, которые получают из обычных соматических клеток взрослого человека путем их «перепрограммирования».
Технологии получения индуцированных плюрипотентных стволовых клеток известны и достаточно хорошо разработаны. Но вот получить из них зрелые бета-клетки гораздо сложнее, так как для этого необходимо буквально в чашке Петри воспроизвести сложнейшие процессы, происходящие во время эмбрионального развития человека, используя сигнальные молекулы и химические соединения, направляющие развитие клеток в нужную сторону.
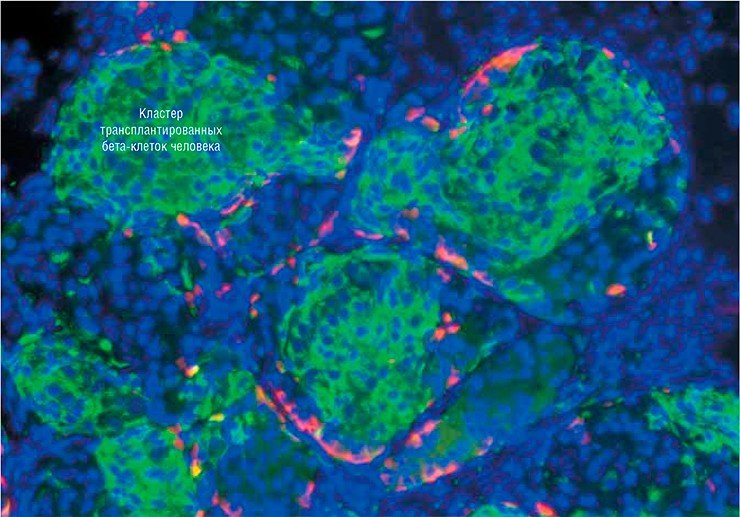 В список выдающихся научных исследований прошлого года, опубликованный журналом Science, как раз и вошли работы двух исследовательских групп: из Гарвардского института стволовых клеток (США) и Медицинской школы Массачусетского университета в Вустере (США) под руководством Д. Мелтона и из Университета провинции Британская Колумбия (Канада) и компании BetaLogics (США) под руководством Т. Кифера, посвященные технологиям получения in vitro бета-клеток поджелудочной железы (Pagliuca et al., 2014; Rezania et al., 2014). Взяв в качестве исходного материала стволовые клетки человеческого эмбриона, в итоге ученые получили клетки, проявляющие все основные качества бета-клеток. То есть в них «работали» определенные гены и присутствовали специфические белки, так что эти клетки были способны продуцировать инсулин в ответ на присутствие глюкозы. Пересаженные лабораторным мышам из чистой линии, служащей экспериментальной моделью сахарного диабета, эти клетки нормально функционировали и компенсировали первоначальное отсутствие инсулина!
В список выдающихся научных исследований прошлого года, опубликованный журналом Science, как раз и вошли работы двух исследовательских групп: из Гарвардского института стволовых клеток (США) и Медицинской школы Массачусетского университета в Вустере (США) под руководством Д. Мелтона и из Университета провинции Британская Колумбия (Канада) и компании BetaLogics (США) под руководством Т. Кифера, посвященные технологиям получения in vitro бета-клеток поджелудочной железы (Pagliuca et al., 2014; Rezania et al., 2014). Взяв в качестве исходного материала стволовые клетки человеческого эмбриона, в итоге ученые получили клетки, проявляющие все основные качества бета-клеток. То есть в них «работали» определенные гены и присутствовали специфические белки, так что эти клетки были способны продуцировать инсулин в ответ на присутствие глюкозы. Пересаженные лабораторным мышам из чистой линии, служащей экспериментальной моделью сахарного диабета, эти клетки нормально функционировали и компенсировали первоначальное отсутствие инсулина!
Огромное преимущество этого метода в том, что с его помощью можно получать функционирующие бета-клетки в довольно большом количестве. В финале процесса из одного флакона для культивирования объемом 0,5 л можно получить до 300 млн клеток – этого числа вполне достаточно, чтобы компенсировать недостающий инсулин у одного человека весом около 70 кг. Или для проведения скрининга среди 30 тыс. отдельных химических соединений – потенциальных лекарственных веществ, если использовать клетки не по «прямому назначению», а для фармакологических исследований.
Безусловно, описанные технологии нуждаются в совершенствовании. В частности, необходима разработка детальных протоколов получения бета-клеток из индуцированных плюрипотентных стволовых клеток. Это позволит не только в любой период жизни пациента и практически из любых клеток его собственного организма при необходимости получить необходимое количество бета-клеток, но и разрешит проблему иммунологической несовместимости донора и реципиента.
Однако остается другая проблема: поскольку диабет 1-го типа – это аутоиммунное заболевание, то новые бета-клетки будут опять атакованы иммунной системой, как когда-то свои «родные» клетки пациента. Поэтому пересаженные клетки надо научиться защищать! Только в этом случае подобное лечение может стать доступным и широко применимым, ведь использование иммунодепрессантов оправдано только в самых тяжелых случаях.
Сейчас разрабатываются разные варианты подобной защиты. Например, можно покрыть клетки специальным гидрогелем, однако в этом случае их будет гораздо труднее удалить из организма при необходимости. К тому же пока не существует способа воспрепятствовать их инкапсуляции (заключению в соединительнотканную оболочку) подобно другим чужеродным телам в организме, что перекроет пересаженным клеткам приток питательных веществ. Сейчас идет поиск химических веществ, пригодных для изготовления гидрогеля, который не будет вызывать такого эффекта.
Другое решение предложили конкуренты команды Мелтона – американская компания ViaCyte. Суть его в том, чтобы поместить пул незрелых бета-клеток внутрь тела в биологически совместимой оболочке: предполагается, что предшественники бета-клеток будут там постепенно созревать и успешно функционировать. Такое устройство уже создано; более того, в компании уже запустили первый этап клинических испытаний. Но хотя результаты аналогичных исследований на животных выглядят многообещающе, есть опасения относительно эффективности этого способа.
В любом случае, уже сейчас имеющиеся технологии внушают надежду, что проблема лечения сахарного диабета будет в скором времени решена. Использование бета-клеток, произведенных из стволовых клеток пациентов, даже при условии постоянного приема иммунодепрессантов может стать огромным облегчением для больных тяжелыми формами диабета, которые постоянно сталкиваются с опасными для жизни изменениями уровня сахара в крови.
Литература
Pagliuca F. W., Melton D. A. How to make a functional β cell. //Development. 2013. V. 140. N. 12. P. 2472—83. DOI: 10.1242/dev.093187.
Pagliuca F. W., Millman J. R., Gürtler M., et al. Generation of functional human pancreatic β cells in vitro. //Cell. 2014. V. 159. N. 2. P. 428—39. DOI: 10.1016/j.cell.2014.09.040.
Rezania A., Bruin J. E., Arora P., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. //Nat. Biotechnol. 2014. V. 32. N. 11. P. 1121—33. DOI: 10.1038/nbt.3033.
Ledford H. Stem-cell success poses immunity challenge for diabetes. //Nature. 2014. V. 514. N. 7522. P. 281. DOI: 10.1038/514281a.
![]()
: 30 Мар 2015 , Наша Арктика , том 61,
№1
Источник


