Русский медицинский журнал сахарный диабет 2 типа
В помощь практическому врачу освещены вопросы лечения больных сахарным диабетом 2 типа и коморбидными заболеваниями
Актуальность
Первые сообщения о диабете появились еще в Древнем Египте, при этом его описывали как заболевание, основными симптомами которого являлись потеря веса и полиурия. Сам термин «диабет» был предложен древнегреческим врачом Aertaeus. Название болезни происходит от греческого слова «диавэно», означающего «прохожу сквозь», «протекаю». Для обозначения сахарного диабета к слову «диабет» добавили mellitus (от латинского mel — мёд) [1].
В наше время проблема СД по-прежнему остается крайне актуальной в связи с тем, что наблюдается неуклонный рост числа пациентов с СД, а также диабету сопутствуют осложнения со стороны различных органов и систем. Согласно данным официальной статистики в России в настоящее время сохраняется высокая распространенность СД2 — им страдают 4,15 млн населения (мужчины — 28,9%, женщины — 71,1%). Средний возраст дебюта СД2 в 2017 г., по данным официальной статистики, составляет 57,8 года, при этом средняя продолжительность жизни данных больных — около 8,5 года [2].
Сахароснижающая терапия с учетом коморбидности СД2
Вместе с тем становится очевидным, что для практикующего врача при таком среднем возрасте дебюта СД2 на первый план выходит проблема коморбидности СД2 с поражением других органов и систем, что особенно важно для подбора сахароснижающей терапии, адекватной клинической ситуации.
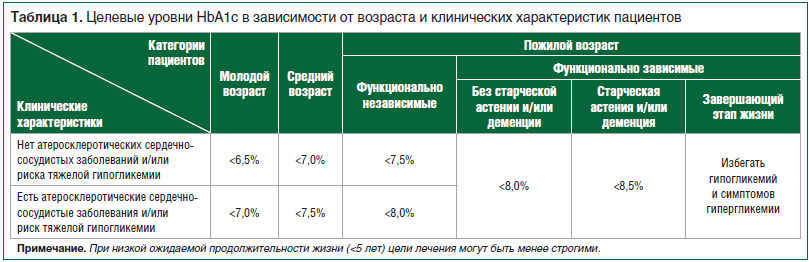
Достижение целевых значений НbА1с у больных СД2 является наглядным отражением эффективности сахароснижающей терапии. Выбор целевого значения НbА1с на современном этапе должен осуществляться с учетом индивидуальных особенностей каждого пациента с СД2, включая возраст, клинические характеристики, а также функциональное состояние (табл. 1) [3].
Современное представление о пациенте с СД2 включает понятие «кардио-рено-метаболического пациента». Другими словами, у пациента с СД2 особенно уязвимы сердечно-сосудистая система, почки и метаболизм. Поэтому с самого начала болезни необходимо отслеживать и уделять должное внимание коррекции нарушений со стороны этих систем с целью комплексной профилактики осложнений и прогрессирования патологии. При СД2 все взаимосвязано, по-видимому, патогенетически, это изначальная коморбидность, а не сочетание заболеваний или последствия гипергликемии, как думали раньше. Понимание этого крайне важно с учетом концепции патогенетического лечения СД2 и попытки коррекции этиологических факторов и всех звеньев патогенеза.
Какие же заболевания наиболее часто сопутствуют СД2? В 2015 г. были опубликованы результаты исследования А. Calderon-Larranaga et al., в котором авторы изучили частоту сопутствующих диабету заболеваний в Испании. Ретроспективно была проанализирована выборка из 10 398 больных СД2 в возрасте старше 14 лет на момент визита. Установлено, что наиболее частыми факторами риска сердечно-сосудистых осложнений (ССО) у больных СД2 являются артериальная гипертония (АГ) (59,32%), нарушения липидного обмена (41,4%) и ожирение (18,48%). Распространенность хронической сердечной недостаточности при этом составляет 4,65% [4]. Эти данные подтверждаются результатами другого исследования, проведенного в Великобритании в 2019 г., в котором были проанализированы медицинские карты 102 394 больных СД2 в возрасте старше 35 лет, которых наблюдали в первичном звене здравоохранения. Авторы установили, что наиболее частым фактором риска ССО у больных СД2 также является АГ (42,8% у мужчин и 45,8% у женщин). Обращает на себя внимание тот факт, что на втором месте у женщин с СД2 была депрессия (20,2%), а у мужчин — ИБС (13,6%) [5].
Метаболический контроль и, в частности, достижение целевого гликемического уровня у больных СД2 по-прежнему остаются актуальной проблемой современной эндокринологии, а многофакторный контроль, включающий достижение целевых уровней АД, холестерина липопротеидов низкой плотности (ХС ЛПНП) (концепция АВС), является фундаментальной основой лечения СД2. В опубликованных недавно европейских клинических рекомендациях по лечению больных СД2 под эгидой Европейского общества кардиологов и Европейской ассоциации по изучению сахарного диабета приведены целевые уровни АД и липидного профиля для больных СД2. Целевой уровень систолического АД (САД) составляет 130 мм рт. ст., но не менее 120 мм рт. ст., при этом у пациентов в возрасте старше 65 лет целевым уровнем САД является диапазон 130–139 мм рт. ст. (класс / уровень доказательности IA). Для пациентов с СД2 с умеренным риском развития ССО целевой уровень ХС ЛПНП составляет < 2,5 ммоль/л, с высоким уровнем ССО — <1,8 ммоль/л, а с очень высоким риском ССО — <1,4 ммоль/л (класс / уровень доказательности I A/B). Также необходимо отметить, что самый высокий класс / уровень доказательности для достижения всех указанных целевых показателей — I А/B, что подразумевает достижение указанных целевых значений абсолютно у всех больных СД2. Таким образом, европейские эксперты заключили, что без проведения адекватной антигипертензивной и гиполипидемической терапии у больных СД2 невозможно добиться существенного успеха в предотвращении сердечно-сосудистых катастроф [6]. Учитывая вышесказанное, очевидно, что лечение больных СД2 на современном этапе должно осуществляться совместно и эндокринологами, и кардиологами.
Профиль межлекарственного взаимодействия вилдаглиптина
Эффективность и безопасность вилдаглиптина у больных СД2 были доказаны результатами большого количества крупных рандомизированных исследований (РКИ), что послужило основанием для включения его в отечественные и международные алгоритмы по диагностике и лечению больных СД2 [3, 4, 7].
Известно, что при адекватной терапии на ранней стадии СД2 уменьшаются осложнения указанного заболевания, инвалидизация и смертность [8–10].В октябре 2019 г. на конгрессе Европейской ассоциации по изучению сахарного диабета, проходившем в Барселоне (Испания), были озвучены результаты РКИ VERIFY, впервые продемонстрировавшего преимущества ранней комбинированной терапии вилдаглиптин + метформин у больных с впервые выявленным СД2. Исследование продолжалось 5 лет и включило 2001 больного СД2 в возрасте 18–70 лет (55% женщин), с показателями HbA1c в диапазоне 6,5–7,5% и индексом массы тела 22–40 кг/м2. Было установлено, что назначение ранней комбинированной терапии вилдаглиптин + метформин позволяет на 49% снизить относительный риск неудачи проводимой терапии (уровень HbA1c ≥ 7,0%) по сравнению с монотерапией метформином исходно. В группе пациентов, исходно получавших монотерапию метформином, уже через 3 года наблюдалось ускользание лечебного эффекта, тогда как в группе ранней комбинированной терапии недостаточный гликемический контроль наблюдался через 5 лет и более. При сравнении этих двух стратегий также выявлено, что в группе ранней комбинированной терапии было на 26% меньше пациентов, которым потребовалась интенсификация лечения с помощью инсулинотерапии [11].
Для пациентов с длительным стажем СД2 и сопутствующей патологией вопросы межлекарственных взаимодействий в настоящее время так же актуальны, как и подбор оптимальной сахароснижающей терапии. Данные 8 ретроспективных и 4 проспективных исследований показали, что самыми частыми классами лекарственных препаратов, вызывающих межлекарственное взаимодействие, являются нестероидные противовоспалительные средства (23,2%), противосудорожные препараты (17,1%), антибиотики (12,6%), препараты для лечения ХОБЛ и бронхиальной астмы (8,9%), анальгетики (8,9%) [12].
Общеизвестно, чтопри увеличении числа препаратов увеличивается риск развития межлекарственных взаимодействий [13]. Актуальность данной проблемы подчеркивается тем, что потенциально опасные межлекарственные взаимодействия являются главной причиной отзыва лекарственного средства с фармацевтического рынка, а серьезные межлекарственные взаимодействия привели к 6,7% от всех госпитализаций в США [14]. В 2019 г. проблема полипрагмазии у больных СД2 была актуализирована результатами метаанализа, проведенного Al-Musawe L. et al., в котором установлена статистически значимая взаимосвязь между полипрагмазией, смертностью от всех причин (ОШ 1,622; 95% ДИ 1,606–1,637, p<0,001) и инфарктом миокарда (ОШ 1,962; 95% ДИ 1,942–1,982, p<0,001) [15].
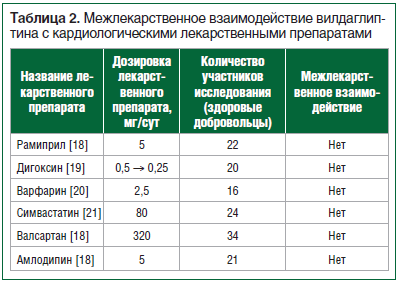
С учетом того, что АГ и нарушения липидного обмена являются наиболее распространенными коморбидными заболеваниями у больных СД2, безопасный профиль межлекарственного взаимодействия вилдаглиптина представляется крайне важным для практикующего врача. Более того, в 2018 г. Национальный институт здоровья и клинического совершенствования Великобритании (NICE) с целью уменьшения неблагоприятных сердечно-сосудистых событий у больных СД2 добавил новые индикаторы для оценки качества процесса лечения, в т. ч. для оценки доли больных СД2, принимающих статины [16].
В исследованиях у здоровых добровольцев не было выявлено межлекарственных взаимодействий вилдаглиптина в дозе 100 мг/сут с часто применяемыми в клинической практике группами препаратов для лечения сердечно-сосудистой системы (ингибиторы АПФ, блокаторы рецепторов ангиотензина II типа 1, антагонисты кальциевых каналов дигидропиридинового ряда, статины, пероральные антикоагулянты, сердечные гликозиды) (табл. 2). Это может объясняться тем, что вилдаглиптин не метаболизируется в печени, не является субстратом изоферментов Р450 (CYP), не ингибирует и не индуцирует изоферменты цитохрома Р450 [17].

В настоящее время у больных СД2 сохраняется высокая распространенность поражения почек: почти у трети диагностирована хроническая болезнь почек (ХБП)
2–5 стадии, характеризующаяся микроальбуминурией/протеинурией и/или сниженной скоростью клубочковой фильтрации (СКФ) [22]. При этом известно, что нарушение функции почек значительно повышает сердечно-сосудистый риск и затрудняет достижение компенсации из-за высокого риска гипогликемий [23]. Вероятной причиной такой высокой распространенности ХБП у больных СД2 может быть связь механизмов развития ХБП с ожирением, АГ, СД и гиперактивностью ренин-ангиотензин-альдостероновой системы [24].
Определение клинических характеристик пациентов с СД2 в сочетании с ХБП существенно ограничило потенциальные варианты сахароснижающей терапии, поскольку данной категории пациентов противопоказана терапия метформином, ингибиторами α-глюкозидазы и большинством препаратов из группы сульфонилмочевины (ПСМ). Набор веса и задержка жидкости при лечении пиоглитазоном, разрешенным к применению в этой популяции, объясняют его низкую привлекательность для пациентов с нарушениями функции почек, а применение инсулинов короткого действия и ПСМ у пациентов со значительно сниженной СКФ повышает риск развития гипогликемии в связи с их непредсказуемым накоплением. Лечение СД2 у пациентов с нарушениями функции почек также осложнено повышенным или непредсказуемым уровнем системного воздействия не только противодиабетических средств, но и других лекарственных препаратов [22].
На фоне этого ингибиторы дипептидилпептидазы-4, проявляющие физиологическую активность, оказались подходящим альтернативным вариантом лечения пациентов с нарушениями функции почек. Данная концепция была подтверждена результатами крупного РКИ (n=525), проводившегося в течение одного года, в котором эффективность и безопасность вилдаглиптина изучали у пациентов с СД2 и умеренными или тяжелыми нарушениями функции почек. Установлено, что профиль безопасности вилдаглиптина в режиме 50 мг 1 р./сут у таких пациентов не отличался от профиля безопасности плацебо. В другом исследовании были определены аналогичные профили безопасности вилдаглиптина и ситаглиптина (n=148) у пациентов с СД2 и тяжелыми нарушениями функции почек. Было выявлено, что лечение вилдаглиптином хорошо переносилось пациентами с СД2 и тяжелыми нарушениями функции почек и недостаточным гликемическим контролем на фоне инсулинотерапии, пожилыми пациентами (≥75 лет) с умеренными или тяжелыми нарушениями функции почек, пациентами с впервые выявленным СД2 после трансплантации и пациентами на гемодиализе, а профиль нежелательных явлений и серьезных нежелательных явлений в группах сравнения существенно не отличался [22].
В 2017 г. D.W. Strain et al. провели всестороннюю оценку соотношения пользы и риска лечения вилдаглиптином пациентов с нарушениями функции почек, в т. ч. в фармакокинетических исследованиях и исследованиях клинической безопасности у пациентов на гемодиализе. Установлено, что фармакокинетический профиль вилдаглиптина у пациентов с умеренными и тяжелыми нарушениями функции почек в сравнении с фармакокинетическим профилем в популяции с сохранной функцией почек показал сопоставимую с максимальной концентрацией инсулина в плазме крови и в 2 раза увеличенную экспозицию вилдаглиптина. Эти наблюдения позволили снизить частоту приема препарата до 1 р./сут и при этом сохранить эквивалентный гликемический эффект, что привело к снижению стоимости терапии вилдаглиптином в 2 раза [25].
Для некомпенсированного СД характерны положительная корреляция с пиелонефритом, циститом и т. д. и склонность к частым обострениям, о которых надо помнить при интенсификации сахароснижающей терапии (в свете рекомендаций о широком назначении ингибиторов натрий-глюкозного котранспортера 2 типа). Все это необходимо учитывать при выборе сахароснижающего препарата, минимизируя риски развития урогенитальной инфекции.
В последние годы появился новый взгляд на формирование доброкачественной гиперплазии предстательной железы (ДГПЖ) как гормонально-метаболического заболевания. Патогенез ДГПЖ долгое время оставался неясным, в последние годы появилась информация о влиянии ожирения, инсулинорезистентности, метаболического синдрома на развитие ДГПЖ [26]. Данная гипотеза была подтверждена результатами сравнительного проспективного исследования у мужичин в возрасте ≥55 лет, в котором была установлена положительная взаимосвязь между наличием СД2 и объемом предстательной железы [27]. В другом исследовании у 117 мужчин пожилого возраста с СД2 и ДГПЖ также была выявлена позитивная взаимосвязь между степенью тяжести СД и объемом предстательной железы [28].
Заключение
Резюмируя, можно заключить, что диагностика и ведение пациентов с СД2 и наличием коморбидных заболеваний в настоящее время остается одной из наиболее сложных задач в клинической практике, а при выборе сахароснижающего препарата должен осуществляться персонифицированный подход с учетом благоприятного профиля межлекарственного взаимодействия назначаемых препаратов. С появлением в клинической практике вилдаглиптина появилась возможность патогенетической терапии, и лечение больных СД2 стало более безопасным и эффективным.
Источник
Метаболический синдром является основой для развития многих заболеваний в развитых странах. К их числу относятся сахарный диабет 2 типа и сердечно–сосудистая патология, стоящие на 2 и 3 месте по причине смертности в мире [3,6,7,8,11].
Метаболический синдром объединяет ряд метаболических и клинико–лабораторных изменений:
– абдоминальное ожирение;
– инсулинорезистентность;
– гиперинсулинемия;
– нарушенная толерантность к глюкозе/СД 2 типа;
– артериальная гипертония;
– дислипидемия;
– нарушение гемостаза;
– гиперурикемия;
– микроальбуминурия.
Метаболический синдром (синдром Х, синдром Ривена, синдром «нового мира», синдром инсулинорезистентности) по числу входящих в него основных факторов риска развития ИБС (абдоминальное ожирение, нарушенная толерантность к глюкозе или сахарный диабет 2 типа, дислипидемия и артериальная гипертензия) называют «смертельным квартетом» [4,6,7].
Одной из главных составляющих метаболического синдрома и патогенеза сахарного диабета 2 типа (рис. 1), является инсулинорезистентность.
Впервые об инсулинорезистентности в 1924 году сообщил Фальта, связав этот феномен не с недостаточностью островкового аппарата b–клеток поджелудочной железы, а с метаболическими нарушениями. В дальнейшем было доказано, что феномен инсулинорезистентности может предшествовать развитию сахарного диабета 2 типа за 10–15 лет [1,7].
Изменение характера питания и качества жизни, сопровождающееся снижением двигательной активности, приводит к развитию ожирения, преимущественно центрального типа, что усугубляет инсулинорезистентность (ИР) жировой ткани и способствует гиперинсулинемии, необходимой для преодоления порога сниженной чувствительности к инсулину. В свою очередь, гиперинсулинемия (ГИ) в современных условиях жизни является пусковым механизмом для развития «порочного круга» (рис. 2): ИР – ГИ – ожирение (как следствие переедания на фоне ГИ – т.е постоянной стимуляции аппетита). Гиперинсулинемия, несмотря на то, что является в данной ситуации компенсаторной реакцией организма в ответ на инсулинорезистентность, также имеет ряд отрицательных последствий. Одним из таких последствий является то, что вследствие прогрессирования ИР исчерпываются возможности b–клеток поджелудочной железы к компенсаторной гиперинсулинемии, что приводит в конечном итоге к нарушению углеводного обмена. Следствием повышения уровня гликемии является эффект глюкозотоксичности, которая, помимо прямого угнетающего действия на секрецию инсулина, способствует снижению чувствительности периферических тканей к инсулину, т.е. усугубляет уже имеющуюся ИР (рис. 2) [7].
Еще одним следствием ИР является нарушение жирового обмена. В условиях гипергликемии и гиперинсулинемии печень начинает синтезировать из глюкозы большое количество триглицеридов, что сопровождается повышением атерогенной фракции холестерина – ЛПНП и снижением антиатерогенной фракции – ЛПВП, способствующих выведению избытка холестерина из сосудистого русла. Эти дислипидемические изменения приводят к прогрессированию атеросклероза.
Артериальная гипертензия имеет место также вследствие повышения реабсорбции натрия в дистальных почечных канальцах в условиях гиперинсулинемии. Это ведет к задержке жидкости и увеличению ОЦК. Помимо этого, при гиперинсулиемии имеет место компенсаторное повышение тонуса симпатической нервной системы с последующим увеличением сосудистого тонуса, т.е. ОППС. Особое внимание в этой ситуации следует обратить на то, что ИР и ГИ являются, таким образом, самостоятельными факторами риска развития артериальной гипертензии (даже без нарушений углеводного обмена).
Следующим нарушением, развивающимся в условиях ГИ, является нарушение фибринолитической активности крови за счет повышенного синтеза в жировой ткани ингибитора активатора плазминогена (ПАИ–1), что приводит к снижению фибринолиза [6,7].
Таким образом, основной причиной развития основных компонентов «смертельного квартета» является гиперинсулинемия в качестве компенсаторной реакции b–клеток поджелудочной железы на инсулинорезистенстность. Клинически это феномен чаще всего проявляется абдоминальным типом ожирения с соотношением ОТ/ОБ у женщин более 0,85 и у мужчин более 1,0. Однако лица без ожирения, страдающие СД 2 типа и артериальной гипертензией, также могут быть инсулинорезистентными, причем в более выраженной степени, чем лица без диабета.
Учитывая то, к каким серьезным последствиям приводит гиперинсулинемия и инсулинорезистентность, лечение сахарного диабета 2 типа при наличии этих двух компонентов следует направлять не только на нормализацию уровня гликемии, но и на устранение ГИ и ИР.
Препаратом выбора в данном случае являются бигуаниды [2,4,5,9]. В настоящее время единственным препаратом этой группы, разрешенным к применению, является метформин (Сиофор). Этот препарат увеличивает утилизацию глюкозы периферическими тканями, снижая инсулинорезистентность печеночной, мышечной и других тканей, уменьшает продукцию глюкозы печенью посредством влияния на глюконеогенез, снижает гликогенолиз (рис. 3). Его эффект можно охарактеризовать, скорее, как антигипергликемический, чем гипогликемический, поскольку на фоне приема метформина не развиваются гипогликемические состояния даже при снижении массы тела [4].
Помимо влияния на продукцию и метаболизм глюкозы, метформин, являясь уникальным препаратом, влияет и на все остальные патологические звенья метаболического синдрома. Угнетая липолиз в жировой и мышечной ткани, метформин тем самым способствует снижению концентрации свободных жирных кислот с последующим снижением синтеза триглицеридов и атерогенных фракций холестерина. Также в многочисленных исследованиях была доказана способность метформина снижать агрегационную активность тромбоцитов, что крайне важно при сахарном диабете, где повышенная агрегация тромбоцитов является одним из существенных факторов развития обтурации капилляров.
Противопоказанием к назначению метформина являются гипоксические состояния любого генеза (шок, сепсис, кровопотеря, выраженная дыхательная недостаточность II–III ст., сердечно–сосудистая недостаточность II–III ст., выраженные нарушения печеночного и азотистого обмена, хронический алкоголизм и др.). Достаточно часто у врачей возникает вопрос о назначении метформина пациентам с ИБС. Если у больного ИБС со стабильной стенокардией II ФК без явлений сердечной недостаточности, то ничто не может помешать врачу назначить такому пациенту бигуаниды. Не так давно возраст старше 65 лет также считался противопоказанием к назначению метформина, однако большинство исследователей в настоящее время придерживаются мнения, что препарат можно назначать и в более старшем возрасте (до 80 лет), оценивая психосоматическое состояния и сохранность каждого пациента в конкретном случае.
Злоупотребление алкоголем также является противопоказанием для назначения метформина. Прием алкоголя даже у здоровых лиц сопровождается временным повышением уровня лактата в крови. Данные о лактатацидозе в анамнезе также не позволяют подключить метформин к терапии [4,9].
Временная отмена метформина должна производиться перед исследованиями, сопровождающимися внутривенным введением йод–контрастных веществ, которые могут вызвать острое нарушение функции почек и повлечь за собой лактатацидоз.
Полостные и обширные хирургические вмешательства являются абсолютным показанием к временной отмене метформина, причем, учитывая его кумуляцию в организме, отмена должна быть произведена за 48 часов до предполагаемой операции. Если же это происходит в экстренном порядке, то отмена производится непосредственно перед вмешательством.
Как правило, при метаболическом синдроме начальная доза составляет 500 мг в последний прием пищи. Препарат принимается во время или после еды. В дальнейшем при необходимости доза может быть постепенно увеличена до 3 г в сутки. Из побочных эффектов наиболее часто встречаются реакция со стороны желудочно–кишечного тракта, аллергические реакции и лактатацидоз при несоблюдении противопоказаний к назначению препарата. Специфическим побочным эффектом при приеме препарата натощак является металлический привкус во рту, который проходит, как только пациент начинает правильно принимать метформин (во время или сразу после еды).
Эффект от назначения препарата оценивается на 7–10 день от начала приема. Монотерапия метформином актуальна у пациентов с выраженным избытком массы тела, с умеренно повышенными цифрами гликемии. В таком случае препарат назначают сначала 1 раз в сутки во время последнего приема пищи, но не позднее 21–22 часов в дозе 500 мг, с последующим увеличением дозы до 1,5–3,0 г в сутки. Обязательным является контроль уровня печеночных ферментов и азотистого обмена на фоне приема препаратов этой группы. При монотерапии метформином уровень HbA1c снижается на 0,9–1,5% [5,9].
В развитии СД 2 ведущую роль играют инсулинорезистентность и нарушение секреторной функции b–клеток поджелудочной железы. Поэтому патогенетически обоснованным является одновременное воздействие на оба механизма развития болезни. Такое воздействие обеспечивает комбинированная сахароснижающая терапия, когда один препарат снижает инсулинорезистентность, а другой усиливает секрецию инсулина b–клетками поджелудочной железы.
Самой эффективной является комбинация метформина с препаратами сульфонилмочевины. При комбинации сульфонилмочевины с метформином уровень гликемии в среднем снижается на 3,6 ммоль/л, а уровень HbA1c на 1,7%. В то же время применение раздельной комбинированной сахароснижающей терапии имеет определенные недостатки и ограничения. При назначении раздельной комбинированной терапии больной вынужден принимать большое количество таблеток, что снижает соблюдение больным врачебных рекомендаций и приводит к существенному уменьшению сахароснижающего эффекта [5].
Для улучшения комплайнса и удобства пациентов фармацевтической компанией Берлин–Хеми был разработан уникальный комбинированный препарат сульфонилмочевины и бигуанида (глибенкламид + метформин) – Глибомет. В состав 1 таблетки входит 2,5 мг глибенкламида и 400 мг метформина. Препарат назначается в один или два приема утром и/или вечером во время еды. Максимальная суточная доза – 5 таблеток.
Глибомет рекомендуется использовать не только при неэффективности монотерапии, но и в качестве средства первоочередного выбора при лечении СД 2 типа. Эта рекомендация также связана с принятием интенсивной тактики лечения СД 2 типа. Комбинированные сахароснижающие препараты назначают больным СД 2 типа, которым ранее медикаментозная сахароснижающая терапия не применялась, в следующих случаях:
– при изначально агрессивном течении заболевания (уровень гликированного гемоглобина более 8%);
– при поздней диагностике СД 2 типа, особенно когда одновременно с установлением диагноза СД 2 типа уже имеются характерные для диабета осложнения [5].
Таким образом, Глибомет является препаратом выбора для пациентов, у которых сахарный диабет 2 типа рассматривается в рамках метаболического синдрома с уровнем гликемии, требующим добавления препаратов сульфонилмочевины для стимуляции выработки инсулина.
Литература
1. Балаболкин М.И., Клебанова Е.М., Креминская В.М. Возможности лечения сахарного диабета 2 типа на современном этапе.// Русский медицинский журнал. – Т.10. – №11. – 2002. – С.496–502.
2. Бутрова С.А. Эффективность Глюкофажа в профилактике сахарного диабета 2 типа.//.// Русский медицинский журнал. – Т.11. – №27. – 2003. – С.1494–1498.
3. Дедов И.И., Шестакова М.В. Сахарный диабет. Руководство для врачей. – М. – 2003. – С.151–175.
4. Дедов И.И., Демидова И.Ю. Бигуаниды в современной практике лечения сахарного диабета 2 типа.
5. Древаль А.В., Мисникова И.В. Роль сахароснижающих таблетированных препаратов в лечении сахарного диабета 2 типа.// Российский медицинский журнал. – Т.13. – №6. – 2005. – С.332–334.
6. Недосугова Л.В. Метаболический синдром в практике врача–эндокринолога./ Материалы 2–го Московского съезда эндокринологов. – М. – 1999. – С.104–106.
7. Смирнова О.М. Впервые выявленный сахарный диабет 2 типа. Диагностика, тактика лечении. Методическое пособие.
8. Hermann L.S., Schersten B., Bitzer P.O. et al. Therapeutic comparison oа metformin and sulfanilyrea, alone and in varios combinations. A double–blend controlled study (see comments). Diabetes Care.17 (10): 1100–9, 1994 Oct.
9. Hermann L.S., Bitzer P.O., Kjellstrom T et al. Comparative efficacy of Metformin and Glibenclamide in patients with NIDDM. Diabete &Metabolisme (Paris), 1991, 17, pp.201–208.
10. Reaven G.M.// Diabetes. – 1988. – Vol.37. – P.1595–1607.
Источник
